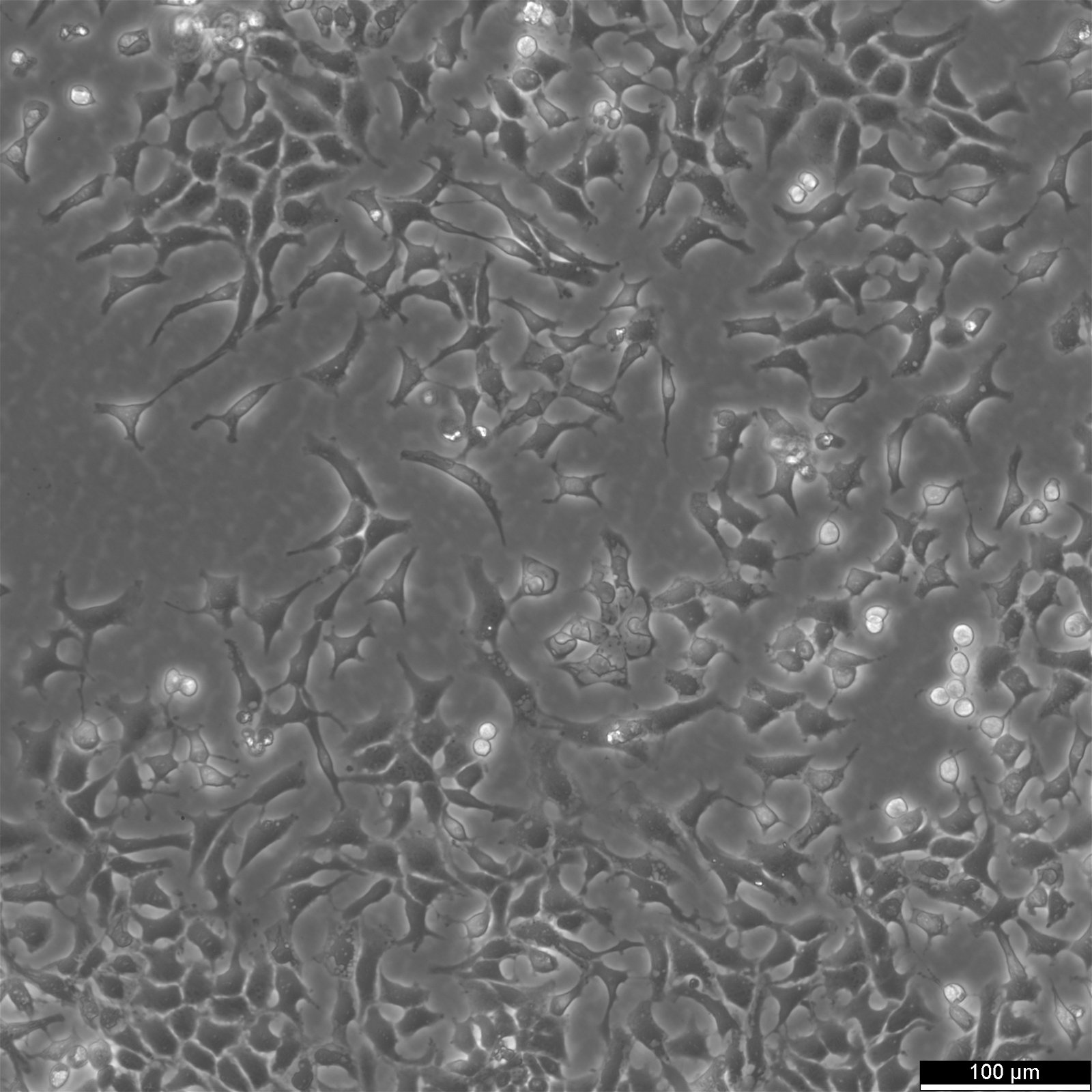
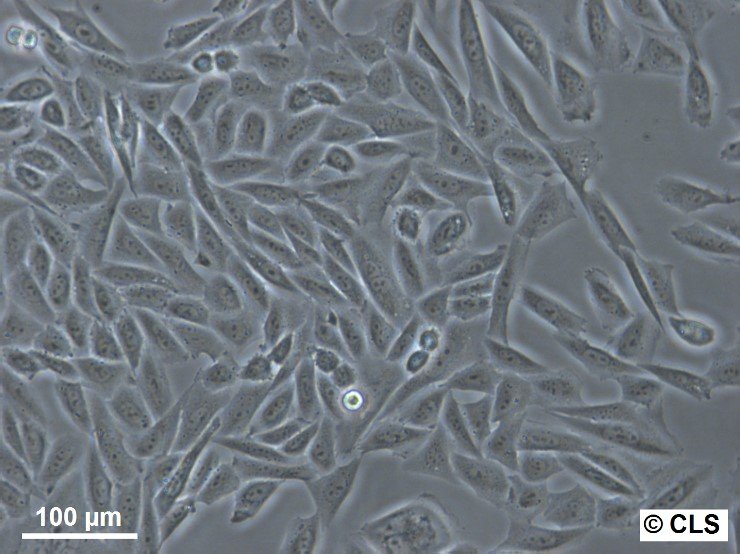
CHO-Zellen in der Bioproduktion: Anwendungen und Innovationen
DieCHO-Zelllinie, die aus dem Eierstock des chinesischen Hamsters gewonnen wird, ist mit ihrem breiten Anwendungsspektrum ein Kraftpaket in der medizinischen und biologischen Forschung. Diese Säugetierzelllinie bietet unendlich viele Möglichkeiten, von der rekombinanten Proteinproduktion bis hin zur Genexpression, zum Toxizitätsscreening, zur Ernährung und zu genetischen Studien.
Unser Artikel taucht ein in die faszinierende Welt der CHO-Zellen und zeigt auf, wie diese Zellen die biopharmazeutische Forschung revolutioniert und den Weg für lebensrettende Therapien geebnet haben. Machen Sie sich bereit, die Geheimnisse der mächtigen CHO-Zellen zu lüften und zu entdecken, wie sie bahnbrechende Fortschritte in der Medizin und darüber hinaus ermöglichen! Sie erfahren alles, was Sie wissen müssen, bevor Sie loslegen können, darunter:
Was ist die CHO-Zelllinie?
Seit ihrer Erfindung im Jahr 1957 durch Theodore T. Puck haben sich die CHO-Zellen (Chinese Hamster Ovary) aufgrund ihres schnellen Wachstums und ihrer hohen Proteinproduktion zu einem wichtigen Bestandteil der biologischen und medizinischen Forschung entwickelt. Diese Epithelzellen, die aus dem Eierstock des chinesischen Hamsters gewonnen werden, finden breite Anwendung in den Bereichen Bioproduktion, Genetik, Toxizitätsscreening, Ernährung und Genexpressionsstudien.
CHO-Zellen können Proteine mit posttranslationalen Modifikationen (PTMs) produzieren, die denen des Menschen ähneln. Außerdem fehlt es ihnen an Prolinsynthese und sie exprimieren den epidermalen Wachstumsfaktor-Rezeptor (EGFR) nicht, was sie ideal für die Untersuchung verschiedener EGFR-Mutationen macht.
In der Bioproduktion werden CHO-Zellen in großem Umfang für die Herstellung von monoklonalen Antikörpern, rekombinanten Proteinen und Impfstoffen verwendet. Mehr als 60 therapeutische Proteine, die mit CHO-Zellen hergestellt wurden, sind für die Produktion zugelassen, und ihre Verwendung nimmt weiter zu. Unser Artikel befasst sich mit den bemerkenswerten Eigenschaften und vielfältigen Anwendungen von CHO-Zellen und hebt ihre entscheidende Rolle bei der Förderung von Fortschritten in der Biomedizin und darüber hinaus hervor. Machen Sie sich bereit für eine Entdeckungsreise in die faszinierende Welt der CHO-Zellen und entdecken Sie ihr unvergleichliches Potenzial in der biomedizinischen Forschung!
CHO-Zellen: Die erste Wahl der biopharmazeutischen Industrie für die Produktion rekombinanter Proteine
In der Biotechnologiebranche werden CHO-Zellen (Chinese Hamster Ovary) häufig zur Herstellung von Biopharmazeutika wie monoklonalen Antikörpern, rekombinanten Proteinen und Impfstoffen verwendet.
Auch wenn Sie sich dessen vielleicht nicht bewusst sind, könnten Chinesische Hamster-Ovarialzellen (CHO) daran schuld sein, wenn Sie sich jemals einer monoklonalen Antikörpertherapie unterzogen haben. Diese anpassungsfähigen Zellen werden von der biopharmazeutischen Industrie häufig zur Herstellung rekombinanter Proteine verwendet, die in der biomedizinischen Forschung, in der Diagnostik und für eine Vielzahl von Therapeutika eingesetzt werden. Auf Proteinen basierende Therapeutika, so genannte monoklonale Antikörper (mAbs), werden zur Behandlung einer Vielzahl von Krankheiten wie Krebs, Autoimmunerkrankungen und Infektionskrankheiten eingesetzt. Da sie posttranslationale Modifikationen durchführen, die denen in menschlichen Zellen ähneln, werden häufig CHO-Zellen zur Herstellung von mAbs verwendet. Diese Modifikationen sind notwendig, damit diese Therapeutika richtig funktionieren.
Durch Gentechnik hergestellte Proteine werden als rekombinante Proteine bezeichnet. Sie dienen nicht nur als Forschungsreagenzien, sondern können auch als Therapeutika und Diagnostika verwendet werden. Da sie posttranslationale Modifikationen erfahren können und komplexe Glykosylierungen aufweisen, die denen in menschlichen Zellen ähneln, eignen sich CHO-Zellen aufgrund ihres schnellen Wachstums, ihrer hohen Proteinexpression und ihrer Fähigkeit, große Mengen an Proteinen zu exprimieren, besonders gut zur Herstellung rekombinanter Proteine. Mit Ausbeuten von 3 bis 10 Gramm pro Liter Kultur ist die CHO-Zelllinie dank ihrer unübertroffenen Fähigkeit zur Massenproduktion von therapeutischen Proteinen ein Wendepunkt in der Biopharmazie. Dank der genetischen Optimierung, die ihre Fähigkeit zur Herstellung großer Mengen rekombinanter Proteine erhöht, sind CHO-Zellen heute ein wesentlicher Bestandteil der modernen Biomedizin.
Impfstoffe sind Biopharmazeutika, die zur Vorbeugung und Behandlung von durch Viren und Bakterien verursachten Infektionen eingesetzt werden. Auch Impfstoffe gegen COVID-19 werden mit CHO-Zellen hergestellt. Wissenschaftler haben eine Reihe von Techniken entwickelt, darunter Gentechnik, Medienoptimierung und Prozessentwicklung, um die Leistung von CHO-Zellen bei der Herstellung von Biopharmazeutika zu verbessern. Diese Techniken haben zur Entwicklung von ertragreichen und kostengünstigen Kultursystemen für die Produktion von Biopharmazeutika mit CHO-Zellen geführt. Die breite Palette von Anwendungen für CHO-Zellen umfasst:
CHO-Zellen in der biopharmazeutischen Produktion
CHO-Zellen werden zur Herstellung verschiedener Biotherapeutika verwendet, darunter rekombinante Proteine und monoklonale Antikörper, die zur Behandlung von Krankheiten wie Krebs, Autoimmunerkrankungen und Infektionskrankheiten eingesetzt werden. Der Einsatz von CHO-Zellen in Biopharmazeutika ist weitgehend auf ihre Fähigkeit zurückzuführen, posttranslationale Modifikationen ähnlich wie menschliche Zellen durchzuführen, was sie zu idealen Säugetierwirten für die Herstellung human-kompatibler therapeutischer Proteine macht. Ein umfassendes Verständnis der CHO-Wirtszellproteinprofile und die Anwendung von Wirtszellprotein-ELISA-Techniken sind unerlässlich, um die Reinheit und Sicherheit der in CHO-Zellsystemen hergestellten Biopharmazeutika zu gewährleisten. Infolgedessen haben CHO-Zellen ihre Position als multifunktionale Plattform in der Biotechnologiebranche gefestigt.
Fortschritte in der CHO-Zell-basierten Antikörperproduktion
CHO-Zellen werden in großem Umfang zur Herstellung von monoklonalen Antikörpern verwendet, die das Feld der Biomedizin revolutioniert haben, indem sie gezielte Therapien für verschiedene Krankheiten ermöglichen. CHO-Zellen sind aufgrund ihrer Fähigkeit, menschliche Proteine korrekt zu falten, zu assemblieren und zu modifizieren, zum Eckpfeiler der rekombinanten Antikörper-Expression und der Produktion von Proteintherapeutika geworden. Die Produktion von Antikörpern in CHO-Zellen hat sich mit der Verbesserung der Zellkulturtechniken und des CHO-Zell-Engineerings weiterentwickelt und zu qualitativ hochwertigen CHO-Zellen geführt, die für die Entwicklung von Biopharmazeutika von zentraler Bedeutung sind. Umfassende biotechnologische Ansätze, einschließlich DNA-Technologie und hochentwickelter Zellkulturmethoden, wurden angewandt, um CHO-Zellsysteme für eine effizientere Antikörperproduktion zu optimieren.
Molekularbiologie und CHO-Zelltechnik
Die Verschmelzung von molekularbiologischen Techniken mit der CHO-Zellkultivierung hat zur Schaffung transgener CHO-Zelllinien und zur Manipulation von Mutanten der chinesischen Hamsterzelle geführt, um die gewünschten Eigenschaften zu erzielen. Diese Fortschritte im Zell-Engineering und in der DNA-Technologie haben die Entwicklung von CHO-Zellen ermöglicht, die in der Lage sind, spezifische rekombinante Proteine mit hoher Wirksamkeit zu produzieren. Die Erforschung von Kulturansätzen für eukaryotische Zellen, einschließlich CHO- und HeLa-Zellen, hat zu einem besseren Verständnis der zellulären Mechanismen und zur Optimierung von Säugetierzellkulturen für die Produktion therapeutischer Proteine beigetragen.
Aber das ist noch nicht alles! CHO-Zellen haben weitere faszinierende Anwendungen in der biomedizinischen Forschung, darunter:
- Toxizitätsscreening: CHO-Zellen werden verwendet, um die Toxizität von Arzneimitteln, einschließlich krebsbekämpfender und antiviraler Therapeutika, zu bewerten. In einer Studie wurde beispielsweise die brustkrebsspezifische Wirkung von aus antarktischen Mikroalgen gewonnenen Fettsäuren untersucht, wobei CHO als Kontrollzelllinie verwendet wurde.
- Genexpression: CHO-Zellen werden zur stabilen und transienten Expression von Genen für Studien zur Genfunktion oder zur gezielten Proteinproduktion verwendet. Mit Hilfe von Gen-Editierwerkzeugen werden Gen-Knock-in- und Knock-out-Modelle in CHO-Zelllinien entwickelt.
Zukunftsperspektiven in der CHO-Zellforschung
Die laufende Forschung und Entwicklung im Bereich der CHO-Zellsysteme konzentriert sich auf die Steigerung der Effizienz und Vielseitigkeit dieser Zellen in der biopharmazeutischen Produktion. Da CHO-Zellen nach wie vor an der Spitze der rekombinanten Proteintherapeutika stehen, spielt ihre Rolle in der Zukunft der Medizin und Biotechnologie eine bedeutende Rolle und verspricht neue Fortschritte bei der Antikörperentwicklung und der Herstellung lebensrettender Behandlungen.
Entdecken Sie die Vorteile der mächtigen CHO-Zellen
Im Folgenden werden einige wichtige Vorteile der CHO-Zelllinie aufgeführt, die sie zu einem attraktiven Forschungsinstrument machen.
- Leichte Kultivierung: Die Kultivierungsverfahren und -bedingungen der CHO-Zelllinie sind nicht pingelig. Diese Zellen sind widerstandsfähig und können unterschiedliche Temperaturen und pH-Werte vertragen. Daher sind sie ideal für die Kultivierung in großem Maßstab.
- Posttranslationale Modifikationen: Diese Zellen ähneln menschlichen Zellen und sind in der Lage, ähnliche posttranslationale Modifikationen zu produzieren. Daher können CHO-Zellen zur Herstellung biokompatibler biologischer Produkte mit ausgezeichneter pharmazeutischer Aktivität verwendet werden.
- Hohe Produktivität: CHO-Zellen werden häufig für die Herstellung rekombinanter Proteine mit hoher Ausbeute verwendet. Die genetische Optimierung der CHO-Zelllinie hat zu einer Ausbeute von etwa 3-10 Gramm Protein pro Liter Kultur geführt.
- Genexpression: CHO-Zellen sind leicht zu transfizieren und werden daher häufig für transiente und stabile Expressionsstudien verwendet. Darüber hinaus werden viele genetische Werkzeuge zur Entwicklung von Gen-Knock-in- und Knock-out-Modellen unter Verwendung der CHO-Zelllinie eingesetzt.
- Staatliche Genehmigungen: CHO-Zellen wurden in fast 50 in den USA und der EU zugelassenen Biotherapeutika verwendet.
- Geringe Virusanfälligkeit: Da die Zellen vom Hamster stammen, ist das Risiko der Vermehrung menschlicher Viren geringer, was Produktionsverluste verringert und die biologische Sicherheit erhöht.
Hauptmerkmale von CHO-Zellen
Morphologie: CHO-Zellen haben ein epitheliales, längliches und fibroblastenähnliches Aussehen. Sie sind adhärent und wachsen normalerweise in Monolayern.
Zellgröße: Der durchschnittliche Durchmesser von CHO-Zellen liegt zwischen 12-14 μm.
Genom und Ploidie: CHO-Zellen sind aneuploid und besitzen 21 Chromosomen, was sich von der euploiden Chromosomenzahl des chinesischen Hamsters unterscheidet. Der Karyotyp von CHO-Zellen ist durch zahlreiche strukturelle Umlagerungen gekennzeichnet, darunter der teilweise Verlust von Chromosom 2 und X-Material.
Vergleich zwischen CHO- und CHO-K1-Zelllinie
Seit die ursprüngliche CHO-Zelllinie 1956 vorgestellt wurde, sind viele Variationen der Zelllinie für verschiedene Zwecke entwickelt worden. CHO-K1 wurde 1957 aus einem einzigen Klon von CHO-Zellen erzeugt, und CHO-DXB11 (auch bekannt als CHO-DUKX) wurde später durch Mutagenese mit Ethylmethansulfonat hergestellt. Ihre Nützlichkeit war jedoch begrenzt, da sie nach einer Mutation wieder zur DHFR-Aktivität zurückkehren konnten. Später wurden CHO-Zellen mit Gammastrahlung mutagenisiert, um CHO-DG44 herzustellen, bei dem beide DHFR-Allele vollständig eliminiert wurden. Diese DHFR-defizienten Stämme benötigen Glycin, Hypoxanthin und Thymidin für ihr Wachstum und werden häufig für die industrielle Proteinproduktion verwendet. Inzwischen sind andere Selektionssysteme populär geworden, und es hat sich gezeigt, dass Wirtszellen wie CHO-K1, CHO-S und CHO-Pro minus hohe Mengen an Proteinen produzieren. Aufgrund der genetischen Instabilität werden diese Zelllinien häufig in Suspensionskultur-Bioreaktoren in Medien kultiviert, die frei von tierischen Bestandteilen oder chemisch definiert sind. Die Komplexität der CHO-Zellgenetik und der klonalen Ableitung wurde ebenfalls erörtert.
Erschließen Sie mit unseren CHO-Zellen bahnbrechende Ergebnisse
Zehn Tipps zur Kultivierung von CHO-Zellen
- Die CHO-Zelllinie ist eine wartungsarme Zelllinie, die einfach zu kultivieren ist.
- CHO-Zellen haben eine schnelle Populationsverdoppelungszeit von 14-17 Stunden.
- CHO-Zellen sind adhärent und wachsen in Monolayern oder können in Suspension kultiviert werden.
- Subkultivieren Sie CHO-Zellen bei 80-90 % Konfluenz mit Accutase.
- CHO-Zellen mit einer Zelldichte von 1 x104 Zellen/cm2 aussäen, um in etwa 4 Tagen einen konfluenten Monolayer zu erhalten.
- Für eine optimale Kultivierung verwenden Sie eine 50:50 DMEM- und Ham's F12-Mischung, ergänzt mit 5% FBS und L-Glutamin.
- Erneuern Sie das Wachstumsmedium 2-3 Mal pro Woche.
- CHO-Zellen in einem befeuchteten Inkubator mit 5% CO2-Gas bei 37°C kultivieren.
- CHO-Zellen in der Dampf- oder Flüssigphase von flüssigem Stickstoff (-196°C) lagern.
- Befolgen Sie die Richtlinien der Biologischen Schutzstufe 1 für die Handhabung und Kultivierung der CHO-Zelllinie.
Protokolle, Videos und aktuelle Veröffentlichungen zu CHO-Zellen
Hier finden Sie einige ausgezeichnete Ressourcen, um sich über die Kultivierung und Pflege von CHO-Zelllinien zu informieren.
- Ein ausführliches Zellkulturprotokoll über CHO-Zellen: Über diesen Link können Sie alles über die Subkultivierung und Transfektion von CHO-Zellen erfahren.
- CHO-Zellen: Auf dieser Website finden Sie grundlegende Informationen über die Zellkultur der CHO-Zelllinie, einschließlich Teilung, Lagerung, Einfrieren und Auftauen von Zellen, usw.
- Auftauen von CHO-Zellen: Dieses Video zeigt ein beispielhaftes Auftauprotokoll für gefrorene CHO-Zellen.
Transfektionsprotokolle für CHO-Zelllinien
CHO-Zellen eignen sich hervorragend für die transiente und stabile Transfektion von Genen. Hier finden Sie einige Ressourcen mit hilfreichen Informationen zu Transfektionsprotokollen für CHO-Zelllinien.
- CHO-Zell-Transfektion: Dieser veröffentlichte Artikel enthält ein transientes Transfektionsprotokoll für die CHO-Zelllinie unter Verwendung von linearem Polyethylenimin (PEI).
- Transfektionsmethoden für CHO-Zellen: Dieser Artikel erläutert verschiedene Strategien für eine effiziente Transfektion von CHO-Zelllinien unter Verwendung verschiedener Transfektionsreagenzien.
- Transiente Transfektion von CHO-Zellen: In diesem Video werden anhand von Illustrationen grundlegende Konzepte für transiente Expressionsstudien in CHO-Zellen erläutert.
Häufig gestellte Fragen zu CHO-Zellen
Interessante Forschungspublikationen mit CHO-Zellen
Im Folgenden finden Sie Zusammenfassungen verschiedener Studien, in denen CHO-Zellen verwendet wurden:
Studie: "Schnelle, ertragreiche Produktion der SARS-CoV-2-Spike-Ektodomäne in voller Länge durch transiente Genexpression in CHO-Zellen" (2021)
- Ziel: Expression der SARS-CoV-2 Spike-Ektodomäne in CHO-Zellen unter Verwendung von drei transienten Transfektionsmethoden für hohe Produktivität.
- Methodik: CHO-Zellen wurden mit Plasmiden transfiziert, die für die SARS-CoV-2-Spike-Ektodomäne in voller Länge kodieren, wobei drei transiente Transfektionsmethoden angewandt wurden. Die Proteinexpression wurde mittels ELISA und Western Blot untersucht.
- Wichtigste Ergebnisse: Alle drei transienten Transfektionsmethoden zeigten eine hohe Proteinexpression, wobei die höchste Ausbeute mit der Polyethylenimin-Methode erzielt wurde.
Studie: "Entwicklung einer stabilen CHO-Zelllinie für die Expression eines MERS-Koronavirus-Impfstoff-Antigens" (2018)
- Zweck: Herstellung von MERS-Coronavirus-Antigen in CHO-Zellen zur Verwendung als zukünftiger Impfstoffkandidat.
- Methodik: CHO-Zellen wurden mit einem Plasmid transfiziert, das für das MERS-Coronavirus-Antigen kodiert, und mit Geneticin auf stabile Expression selektiert. Die Proteinexpression wurde mittels ELISA und Western Blot untersucht.
- Wichtigste Ergebnisse: Die stabile CHO-Zelllinie zeigte eine hohe Proteinexpression und Stabilität über mehrere Passagen.
Studie: "Zytotoxische Aktivität von Fettsäuren aus antarktischen Makroalgen auf das Wachstum von menschlichen Brustkrebszellen" (2018)
- Zweck: Verwendung von CHO-Zellen als Kontrolle, um die Toxizität von Krebsmedikamenten gegenüber normalen Zellen zu bewerten.
- Methodik: CHO-Zellen wurden kultiviert und mit Fettsäuren aus antarktischen Makroalgen behandelt, und die Lebensfähigkeit der Zellen wurde mit dem MTT-Assay bewertet.
- Wichtige Ergebnisse: Fettsäuren aus antarktischen Makroalgen zeigten keine zytotoxischen Wirkungen auf CHO-Zellen, was auf eine mögliche Verwendung als Anti-Krebs-Mittel mit Selektivität für Krebszellen hindeutet.
Studie: "Knockout des Caspase-7-Gens verbessert die Expression des rekombinanten Proteins in der CHO-Zelllinie durch den Zellzyklus-Stillstand in der G2/M-Phase" (2022)
- Ziel: Genetische Manipulation von CHO-Zellen zur Verbesserung der Expression rekombinanter Proteine.
- Methodik: Das Caspase-7-Gen wurde in CHO-Zellen mit Hilfe der CRISPR/Cas9-Technologie ausgeschaltet, und die Proteinexpression wurde mittels Western Blot und Fluoreszenzmikroskopie untersucht.
- Wichtige Ergebnisse: Das Ausschalten des Caspase-7-Gens in CHO-Zellen führte zu einer verbesserten Proteinexpression, was wahrscheinlich auf den durch den Verlust von Caspase-7 verursachten Stillstand des Zellzyklus in der Phase G2/M zurückzuführen ist.
Studie: "Entwicklung einer CHO-Zelllinie für die stabile Produktion von rekombinanten Antikörpern gegen menschliches MMP9" (2015)
- Zweck: Herstellung von monoklonalen Antikörpern gegen das menschliche MMP9-Protein in CHO-Zellen.
- Methodik: CHO-Zellen wurden mit Plasmiden transfiziert, die für den Antikörper gegen menschliches MMP9 kodieren, und mit Genetin auf eine stabile Expression selektiert. Die Proteinexpression wurde mittels ELISA und Western Blot untersucht.
- Wichtigste Ergebnisse: Die stabile CHO-Zelllinie zeigte eine hohe Expression und Stabilität des Antikörpers über mehrere Passagen hinweg, was auf eine mögliche Verwendung in therapeutischen Anwendungen für menschliches MMP9 hindeutet.
Quellenangaben
- Reinhart, D., et al., Bioprocessing of Recombinant CHO-K1, CHO-DG44, and CHO-S: CHO-Expressionswirte begünstigen entweder die mAb-Produktion oder die Biomassesynthese. Biotechnology Journal, 2019. 14(3): p. 1700686.
- Pan, X., et al., Metabolic characterization of a CHO cell size increase phase in fed-batch cultures. Angewandte Mikrobiologie und Biotechnologie, 2017. 101: p. 8101-8313.
- Turilova, V.I., T.S. Goryachaya, and T.K. Yakovleva, Chinese hamster ovary cell line DXB-11: chromosomal instability and karyotype heterogeneity. Molekulare Zytogenetik, 2021, 14(1): S. 1-12.
- Hunter, M., et al., Optimierung der Proteinexpression in Säugetierzellen. Current protocols in protein science, 2019. 95(1): p. e77.
- Nyon, M.P., et al., Engineering a stable CHO cell line for the expression of a MERS-coronavirus vaccine antigen. Vaccine, 2018. 36(14): p. 1853-1862.
- Pacheco, B.S., et al., Zytotoxische Aktivität von Fettsäuren aus antarktischen Makroalgen auf das Wachstum von menschlichen Brustkrebszellen. Frontiers in Bioengineering and Biotechnology, 2018. 6: p. 185.
- Ryu, J., et al. Entwicklung einer CHO-Zelllinie für die stabile Produktion von rekombinanten Antikörpern gegen menschliches MMP9. BMC Biotechnology, 2022. 22(1): p. 8.